03.21
生活習慣病も遺伝する?DNAスイッチでがんも肥満も抑制、エピジェネティクスが拓く遺伝子治療の未来 熊本大学国際先端医学研究機構 エピジェネティック遺伝学研究室 高橋悠太特任准教授(1/4) | JBpress (ジェイビープレス)
人の体は、約37兆個もの多種多様な細胞によってつくられている。とはいえ、どの細胞も元をたどれば受精卵に行き着く。 受精卵が分裂を繰り返してさまざまな細胞へと分化した結果として、人体(1/4)
喫煙や飲酒といった健康に悪い生活習慣で病気になった場合、その変化は子どもに遺伝してしまうのか。従来は後天的に獲得した変化は受け継がれないと考えられてきたが、どうやら運命は「DNAのスイッチ」ともいえるエピジェネティックスが握っている。その謎に迫るのが、熊本大学国際先端医学研究機構の高橋悠太特任准教授だ。スイッチの謎が解明されれば、遺伝的な生活習慣病を受け継いでも、その発現を制御できるかもしれない。エピジェネティクスの第一人者である、高橋准教授に話を聞いた。
(竹林 篤実:理系ライターズ「チーム・パスカル」代表)
遺伝子を「オン/オフ」するスイッチ
人の体は、約37兆個もの多種多様な細胞によってつくられている。とはいえ、どの細胞も元をたどれば受精卵に行き着く。
受精卵が分裂を繰り返してさまざまな細胞へと分化した結果として、人体はできあがる。神経細胞や内臓の細胞など見た目や機能のまったく異なる細胞も、それぞれ持っている遺伝子はまったく同じだ。
つまり肝臓の細胞にも、たとえば神経細胞となるための遺伝子が備わっている。まったく同じ遺伝子を備えているのにもかかわらず、なぜ異なる細胞へと適切に分化していけるのだろうか。
「肝臓になる細胞では、そのために必要な遺伝子のスイッチだけがオンになるからです。他の細胞になるために必要な遺伝子スイッチはオフの状態」
熊本大学国際先端医学研究機構、エピジェネティック遺伝学研究室の高橋悠太特任准教授はそう教えてくれた。このような遺伝子のオン/オフを制御するスイッチのメカニズムを「エピジェネティクス(後成遺伝学)」と呼ぶ。
 高橋 悠太(たかはし・ゆうた)
高橋 悠太(たかはし・ゆうた)熊本大学国際先端医学研究機構 エピジェネティック遺伝学研究室 特任准教授
2011年筑波大学大学院生命環境科学研究科、博士後期課程修了、博士(生物工学)。2012年、米・ソーク研究所ポスドク、2014年、筑波大学生命領域学際研究センター助教、2017年、米・ソーク研究所上席研究員、2022年、米アルトスラボ上席研究員を経て、2024年より現職。
人のDNAには約2万3000個の遺伝子があり、それぞれ違う情報を備えている。どのタイミングで、どの遺伝子の情報を使うのかは精密に制御されている。その仕組みがエピジェネティクス、具体的には遺伝子発現を調節する化学的な変化(「修飾」と呼ぶ)だ。
DNAはA(アデニン)、T(チミン)、G(グアニン)、C(シトシン)の4種類の塩基が連なる二重らせん構造をしている。エピジェネティックな修飾は、4つの塩基のなかでもCにメチル基(CH3)が付くために起きる。
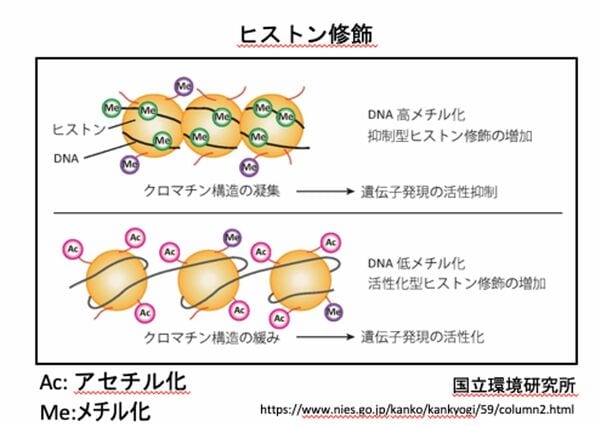
こうした「メチル化」は、細胞の核内でDNAが巻きついている「ヒストン」と呼ばれるタンパク質でも起きる(ヒストン修飾)。こうしたメチル化により、DNA配列そのものが変化しなくても、スイッチのように遺伝子の発現を変えられるのだ。
DNAを変えずに遺伝情報を変える
そもそも遺伝とは、生殖によって親から子へと形質(性質や形)が伝わる現象を意味する。親の持っているDNAの配列が子どもに引き継がれ、その結果として親と子の外見は似てくる。
「親のDNA配列に何らかの病気を引き起こすような遺伝子変異があれば、その変異も子どもに引き継がれていきます。そのために子どもも、親と同じ遺伝子変異によって引き起こされる病気を発症しやすくなります。そこで疑問となるのが遺伝子そのものではなく、遺伝子のスイッチともいえるエピジェネティックな情報も、遺伝子と同じように引き継がれるのかということです。たとえば親のDNAで起こったメチル化が、子どもにも伝わっていくのかどうか。このような現象が実際に起こっているのかどうかは不明でした」
DNAの配列そのものは基本的に生涯を通じて変わらない。けれどもエピジェネティックな変化は、環境要因や生活習慣によっても起こり得る。
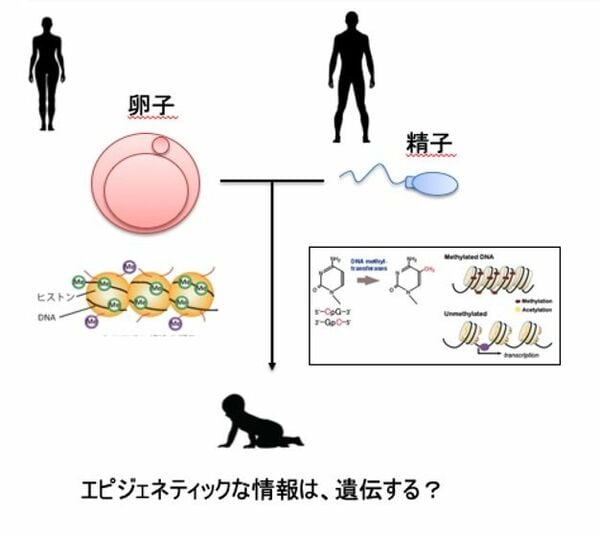
わかりやすい例が、悪い生活習慣によって発症する生活習慣病だ。仮に親が飲酒や喫煙、ストレスなどによって引き起こされたエピジェネティックな変化により、心臓病や糖尿病などの生活習慣病を発症したとする。その場合、親世代で起こったエピジェネティックな変化が、子どもの世代にも引き継がれてしまうのか。
「生物の進化にも関わる問題で、かつてダーウィンの自然選択説に対して、ラマルクは獲得形質の遺伝を主張しました。けれども獲得形質は遺伝しないというのが定説となっていた。ところがDNA配列そのものが環境によって変化しなくとも、エピジェネティックな変異が子世代に遺伝していくのであれば、ラマルク説も正しいかも知れない」
エピジェネティクスが世代を超える事実を実証
哺乳類のDNAはほとんどがメチル化を受けている。けれども、メチル化によるエピジェネティックな情報は、世代を超えて伝わったりはしないと考えられていた。なぜなら受精時にはメチル化が受け継がれていた場合でも、受精後にはいったん脱メチル化されるからだ。
「この脱メチル化によりエピジェネティックな情報は、子どもには受け継がれないと考えられていました。けれども一方では、人の家系図を調べているとメチル化が、子どもに遺伝したような事例が見つかったのです」
ゲノムの安定性を保つためDNA複製時にエラーを修復するがん抑制遺伝子がある。このがん抑制遺伝子に異常なメチル化が起こると、大腸がんを引き起こすリスクが高まる。DNAそのものに異常が起こっていなくても、異常なメチル化だけで大腸がんのリスクが高まるのだ。
そこで不思議な症例が発見された。DNAには変異が見られないにもかかわらず、異常なDNAメチル化だけが起きて大腸がんを発症していた女性がいる。その子どもも、母親と同じように大腸がんを発症した事例が報告されたのだ。
この事例について高橋氏は「母親で起きていた異常なメチル化が、生殖以降のプロセスで起こるはずの脱メチル化を逃れて、子どもに遺伝したように見える」と語る。ただし、遺伝を示唆してはいるものの、結論を出すまでには至っていない。そこで高橋氏は独自の実験によりDNAメチル化の遺伝を確かめようとした。
「メチル化のまったく起きていないワイルドタイプなマウスに対して、DNA配列を変えず特定部分にだけメチル化だけを起こさせました。この際に使用したのが、標的となる遺伝子だけにメチル化を誘導するDNAメチル化技術であり、これは2017年に私たちが開発した独自技術です*1」
具体的なターゲットとなったのはAnkrd26と呼ばれる遺伝子だ。これは肥満に関係する遺伝子であり、通常は完全に非メチル化状態となっている。このAnkrd26をターゲットとして人工的にメチル化を誘導したES細胞を、マウスの胚にインジェクションしてメチル化マウスを作成した。
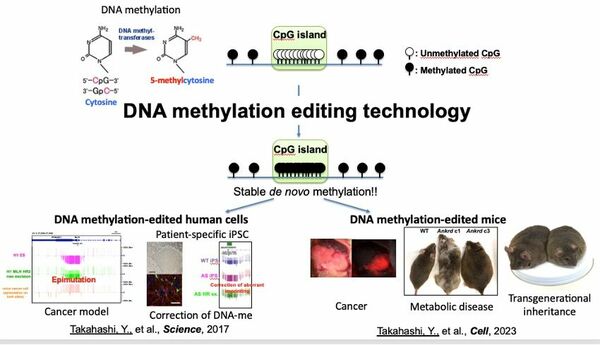
すると誘導されたメチル化はマウスの発生過程でも維持され、肥満のマウスが誕生した。すなわち世界初となるDNAメチル化が編集されたモデル生物の誕生である。
興味深いことに、そのDNAメチル化と肥満の表現型は安定的に子孫に受け継がれた。この成果によりマウスでエピジェネティックな変異が引き継がれている事実が明らかにされた*2。
エピジェネティックメモリの真相究明へ
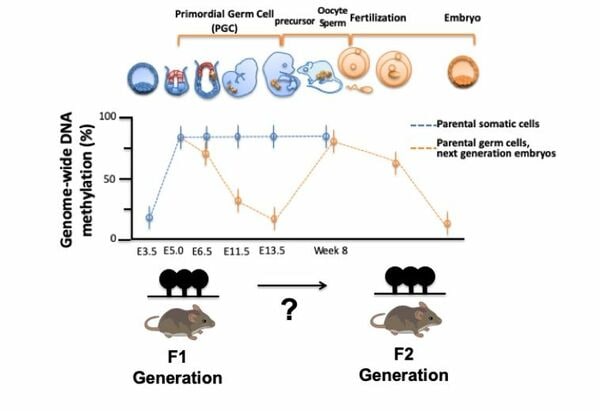
高橋教授らは2023年にこのメチル化マウスを使い、エピジェネティックな変異が代々引き継がれている事実も明らかにした。ただし、まだ謎が完全に解明されたわけではない。なぜなら最終的にメチル化は引き継がれているとはいえ、観察の結果、受精卵はいったんメチル化が消去され、その後再びメチル化している事実も明らかにされているからだ。
「受精卵を調べると、受精後3.5日目の胚盤胞と呼ばれる、受精卵が着床できる状態ではメチル化は見つかりませんでした。ところが着床後6.5日目の多能性の細胞となった段階では、メチル化が見られる。つまり親から受け継いだメチル化は一回消去されるけれども、その後再確立されているのです。この現象をどう理解すればよいか。DNAメチル化自体ではなく、何らかのエピジェネティックなメモリが残っていて、それによってDNAメチル化が再確立されているのだと考えられます」
このエピジェネティックなメモリとは、一体何なのか。どのようにして再確立されるのか。その解明に高橋氏は取り組んでいる。高橋氏らが2023年に発表した論文により、同じテーマでの研究に取り組んでいる研究者もいるはずだ。けれども高橋氏らには決定的なアドバンテージがある。
「メチル化マウスを作製する技術は我々独自のもので、それについて知識の蓄積があります。今後の研究の方向性としては、まずはエピジェネティックメモリの実態を解明したいと思います。その上で同じ現象がヒトでも起きているのかを確認したい。これが明らかになれば、いわゆる生活習慣病などに関する家族性リスクを軽減できる可能性が出てきます」
仮に親世代が何らかの生活習慣病になった場合、それがエピジェネティックメモリにより子どもにも伝わる可能性がある。まさに「親の因果が子に報いる」という世界だが、エピジェネティックメモリは自力で変えられる可能性もある。
だから、よい生活習慣を心がけていれば、親から伝わっているエピジェネティックメモリを変えて、病気の発症を抑えられる可能性もあるのだ。
*1:Integration of CpG-free DNA induces de novo methylation of CpG islands in pluripotent stem cells. Science. 2017; 356: 503-508.
*2:Transgenerational inheritance of acquired epigenetic signatures at CpG islands in mice. Cell. 2023; 186: 4, 715-731
「Scienc-ome」とは
新進気鋭の研究者たちが、オンラインで最新の研究成果を発表し合って交流するフォーラム。「反分野的」」をキャッチフレーズに、既存の学問領域にとらわれない、ボーダーレスな研究とイノベーションの推進に力を入れている。フォーラムは基本的に毎週水曜日21時~22時(日本時間)に開催され、アメリカ、ヨーロッパ、中国など世界中から参加できる。企業や投資家、さらに高校生も参加している。
>>フォーラムへ
竹林 篤実(たけばやし・あつみ) 理系ライターズ「チーム・パスカル」代表
1960年、滋賀県生まれ。1984年京都大学文学部哲学科卒業、印刷会社、デザイン事務所を経て、1992年コミュニケーション研究所を設立し、SPプランナー、ライターとして活動。2011年理系ライターズ「チーム・パスカル」設立。2008年より理系研究者の取材を開始し、これまでに数百人の教授取材をこなす。他にも上場企業トップ、各界著名人などの取材総数は2000回を超える。著書に『インタビュー式営業術』『ポーター×コトラー仕事現場で使えるマーケティングの実践法がわかる本(共著)』『「売れない」を「売れる」に変えるマーケティング女子の発想法(共著)』『いのちの科学の最前線(チーム・パスカル)』
コメント
この記事へのトラックバックはありません。










この記事へのコメントはありません。